大脑中无时无刻不在进行的动态神经活动,是人类一切心理和行为的生理基础。近年来,发展自系统工程领域的网络控制理论被大量应用于心理学和脑科学研究,通过将大脑视为一个复杂系统,探究神经动态活动跨脑区传播的网络机制。基于大脑的结构连接网络特征,网络控制理论不仅可以鉴别哪些脑区更容易对其它脑区施加影响,还可以通过模拟大脑状态间的转换,探索这些动态进程中大脑的能耗,也称为控制能量(control energy)。作为一个工程学概念,控制能量指的是驱动系统状态改变所需的输入;当应用于模拟大脑的动态进程时,这一“输入”究竟对应何种大脑生理活动,却一直没有答案。生理基础的不足,难免会给网络控制理论在心理学和脑科学研究中的适配性带来质疑,并阻碍其进一步发展。
2022年11月9日,中国科学技术大学心理学系何晓松特任研究员等在Science Advances杂志上发表了题为Uncovering the biological basis of control energy: Structural and metabolic correlates of energy inefficiency in temporal lobe epilepsy的研究论文,通过将单侧颞叶癫痫作为损伤模型,结合弥散加权成像和正电子发射断层扫描等多模态影像技术,揭示了患者大脑中控制能量消耗异常与葡萄糖代谢异常的关联,为网络控制理论在心理学和脑科学研究中的应用提供了潜在的生理基础。
作为重量占比仅2%的人体器官,大脑需要消耗超过人体日均能耗20%的能量以驱动其动态活动,行使日常功能。那么,这种生物学形式的能量消耗,如葡萄糖代谢,是否与工程学意义上的“控制能量”存在联系?为了回答这个问题,团队借鉴神经心理学研究思路,探索了脑疾病相关的病理性损害,是否会带来控制能量和葡萄糖代谢的共变性扰动。基于颞叶癫痫患者和健康对照的大脑结构连接网络,团队通过网络控制理论模拟了两种具有代表性的大脑动态进程,并估算了这些进程中大脑所需消耗的控制能量(图1)。
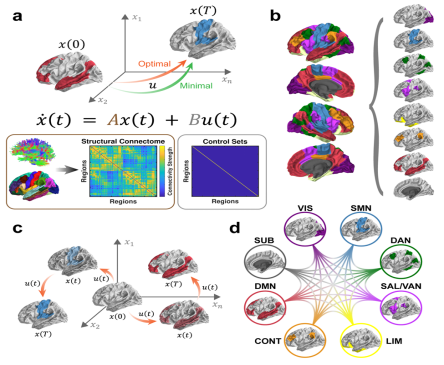
图1 研究方法示意图
结果发现,患者在模拟边缘系统网络(癫痫发作和传播的核心区域)激活过程中所需消耗的控制能量显著高于健康对照组,并且这种能效异常与患者致痫灶的偏侧化高度一致。在患侧海马、杏仁核等7个边缘系统脑区,患者大脑需要消耗更多的控制能量以维系预定的大脑动态进程(图2)。
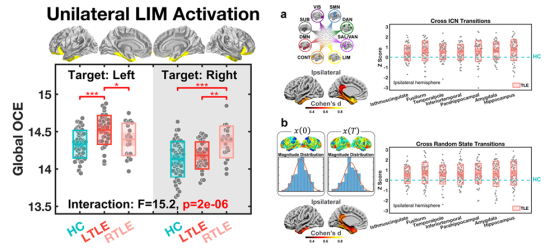
图2 通过网络控制理论模拟大脑动态进程,发现颞叶癫痫患者在整体和局部均存在能效的降低,相比健康对照需要更高的控制能量来实现相同的大脑状态转化
通过正电子发射断层扫描技术,团队证实,这些脑区的基线葡萄糖代谢水平与控制能量消耗水平呈负相关,这也意味着,想要达到同等激活水平,更低的代谢基线可能会带来更高的能量需求,并可通过控制能量这一指标量化。尤其是在海马,更高的结构萎缩与更低的基线葡萄糖代谢、及更高的控制能量消耗相关,并且葡萄糖代谢水平可以完全中介结构萎缩与控制能量消耗二者间的联系。这也提示,海马结构损害可能带来基线葡萄糖代谢的降低,并最终导致在维系大脑动态进程时更高的能耗成本(图3)。

图3 基线葡萄糖代谢水平与控制能量消耗存在负相关
这些发现为大脑结构完整性、葡萄糖代谢基线、与维系大脑动态进程所需的控制能量间的关系提供了一个统一的理论框架。这一工作首次为“控制能量”提供了潜在的生理性解释,为网络控制理论在心理学和脑科学领域的进一步应用奠定了基础。
心理学系何晓松特任研究员为本研究第一作者兼共通讯作者,中国科学技术大学为本研究第一单位,美国宾夕法尼亚大学的Dani S. Bassett教授为本文共通讯作者。本研究得到中国科学技术大学科研启动经费资助。
原文链接:[backcolor=transparent !important]https://www.science.org/doi/10.1126/sciadv.abn2293
